资源目录
1化学能与热能.doc
1化学能与热能.mp4
2原电池.doc
2原电池.mp4
3发展中的化学电源.doc
3发展中的化学电源.mp4
4化学反应的速率.mp4
5化学反应的限度(1).doc
5化学反应的限度.doc
5化学反应的限度.mp4
反应热:
反应过程中放出或吸收的热量,用△H表示,单位为kJ/mol。
总结:放热反应与吸热反应包括哪些反应
吸热反应:
放热反应:
思考:
H2O(l)→ H2O(g)
液态水变成气态水时,能量是如何变化的?能否从微观角度解释能量变化的原因?
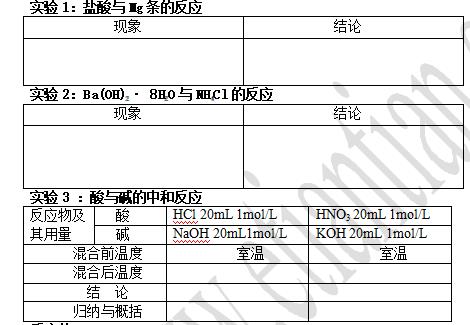
例1:下列反应既属于氧化还原反应,又是吸热反应的是
A.铝片与稀盐酸反应
B.灼热的碳与CO2反应
C.Ba(OH)2·8H2O与NH4Cl反应
D.甲烷在氧气中的燃烧反应
思考和交流:
1.化学反应中为什么会有能量变化?为什么不同反应的热效应不同?
2.氢气和氯气的混合气体遇到强光会发生爆炸,放出大量的热。反应中的热量由何而来?氢气和氯气反应的本质是什么?
引起化学反应中的能量变化:
1.微观:化学键的断裂和形成是化学反应中能量变化的主要原因;
2.宏观:在化学反应中,反应物的总能量与生成物的总能量间的能量差。
例2:下列说法不正确的是
A.化学反应除了生成新物质外,还伴随着能量的变化
B.物质燃烧和中和反应均放出热量
C.分解反应肯定是吸热反应
D.化学反应是吸热还是放热决定于生成物具有的总能量和反应物具有的总能量
例3:已知金刚石在一定条件下转化为石墨是放热的。据此,以下判断或说法正确的是
A.需要加热方能发生的反应一定是吸热反应
B.放热反应在常温下一定很容易发生
C.反应是放热还是吸热,必须看反应物和生成物所具有的总能量的相对大小
D.吸热反应在一定条件下也能发生
例4:已知破坏1mol N≡N键、H-H键和N-H键分别需要吸收的能量为946kJ、 436kJ、391kJ。试计算1molN2(g)和3 molH2(g)完全转化为 NH3(g)的反应热的理论值。
思考:1.能量变化的主要表现形式是什么?
2.在生产生活实际中主要用途是什么?
探索发现一:
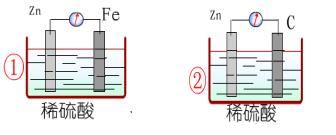
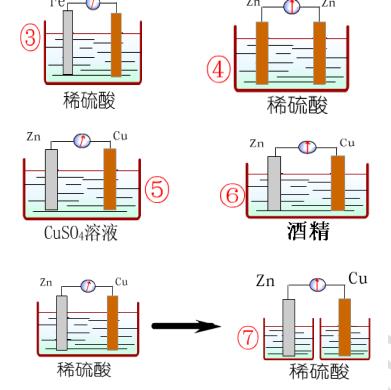
实验仪器和药品:Cu片、 Zn片、 稀硫酸、烧杯、试管、导线、电流计
实验设计:设计图、现象记录、原因
TIP:记录每个金属片上的实验现象、 电流计指针
探索发现二:
目标:根据已具备的氧化还原反应知识和电化学知识,利用提供的实验用品,设计一套电池装置。
用品:镁条、铜片、铁片、导线、金属夹、手电筒用小灯泡(或发光二极管)、果汁(橙汁、苹果汁、柠檬汁等)、500mL烧杯
| 实验目的 | |
| 实验步骤 | |
| 实验现象 | |
| 分析与结论 | |
| 交流与反思 |
[下载参考地址] :双盘下载(百度网盘+诚通网盘)
>>>下载前特别提醒<<<<
1、手机端支付下载建议使用UC浏览器,360浏览器,夸克浏览器,谷歌浏览器
2、电脑端支付下载建议使用谷歌浏览器,360浏览器,搜狗浏览器,opera浏览器
3、支付后不跳转或者支付失败怎么办?[解决方案]
4、不能正常解压或解压失败怎么办?[解决方案]
5、城通网盘下载教程?[解决方案]
- 温馨提示:
- 在微信、微博等APP中下载时,会出现无法下载的情况
- 这时请选择在浏览器中打开,然后再请下载浏览

评论(0)